بدیل گاز گلخانه ای به سوخت مایع
موضوعات مرتبط: شيمي ، ،
برچسبها:
|
يكي از مشكلاتي كه برخي دانش آموزان در درس شيمي 2 با آن مواجه مي شوند، كاربرد دو مفهوم الكترون هاي لايه بيروني (الكترون هاي خارجي) و الكترون هاي ظرفيت است. اين مشكل در مورد عنصرهاي واسطه و واسطه داخلي در بسياري از موارد موجب سردرگمي دانش آموزان مي شود.
در كتاب اصول شيمي عمومي اثر ارزشمند مارتين سيلبربرگ كه توسط اساتيد ارجمند آقايان دكتر مجيد ميرمحمد صادقي، دكتر غلامعباس پارسافر و دكتر محمدرضا سعيدي ترجمه شده است الكترون ها به اين صورت دسته بندي شده اند. يادآوري مي كنم مثال ها و توضيح ارائه شده در متن كتاب نبوده و خودم انها را براي روان تر شدن مطلب اضافه كرده ام.
دسته بندي الكترون ها:
1- الكترون هاي داخلي (مركزي): آنهايي هستند كه در گاز نجيب قبلي و هر سري واسطه كامل شده ديده مي شوند. اين الكترون ها تمام ترازهاي انرژي پايين تر اتم را پر مي كنند.
توضيح- منظور از گاز نجيب قبلي، گاز نجيب دوره قبل هر عنصر است. براي مثال الكترون هاي داخلي اتم عنصر منگنز Mn آنهايي هستند كه در آرايش الكتروني اين عنصر زير آنها خط كشيده شده است.
Mn : 1s2 2s2 2p6 3s2 3p6 4s2 3d5 منبع : وبلاگ دهکده آموزش شیمی همچنين در اتم عنصر آرسنيك الكترون هاي داخلي مشخص شده اند.
As : 1s2 2s2 2p6 3s2 3p6 4s2 3d104p3
2- الكترون هاي خارجي: (الكترون هاي بيروني) آنهايي هستند كه در بالاترين تراز انرژي (بالاترين مقدار n ) قرار گرفته اند. اين الكترون ها اكثر وقت خود را در دورترين فاصله نسبت به هسته سپري مي كنند. الكترون هاي خارجي اتم منگنز با رسم خطي زير آن ها مشخص شده اند.
Mn : 1s2 2s2 2p6 3s2 3p6 4s2 3d5
3- الكترون هاي ظرفيت: آنهايي هستند كه در تشكيل تركيب ها شركت دارند. در بين عناصر گروه هاي اصلي الكترون هاي ظرفيت، الكترون هاي خارجي هستند. الكترون هاي ظرفيت در اتم عنصر آرسنيك As33 مشخص شده اند كه همان الكترون هاي خارجي اتم آرسنيك مي باشند.
As : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
براي عنصرهاي واسطه، همه الكترون هاي ( n – 1)d نيز در بين الكترون هاي ظرفيت به حساب مي آيند. گرچه براي عناصر (26 = Z) Fe تا (30 = Z) Zn فقط چند تاي آنها در تشكيل پيوند، به كار گرفته مي شوند. الكترون هاي ظرفيت در اتم عنصر منگنز مشخص شده اند.
Mn : 1s2 2s2 2p6 3s2 3p6 4s2 3d5 منبع : وبلاگ دهکده آموزش شیمی
|
موضوعات مرتبط: شيمي ، ،
برچسبها:
|
در بحث ایزوتوپ های یک عنصر سوالی که معمولاً بین دانش آموزان مطرح می شود این است که چرا فراوانی ایزوتوپ های یک عنصر با هم تفاوت دارند؟ و چه عامل یا عواملی بر فروانی یک ایزوتوپ موثرند؟ مطلب زیر می تواند تا حد زیادی پاسخ این دو سوال را بدهد. ایزوتوپ پایدار، ایزوتوپی است که هسته آن خود به خود واپاشیده نشود. هسته ناپایدار هسته ای است که خود به خود دچار نوعی تغییر می شود. با استفاده از سه قاعده زیر می توانیم تخمین بزنیم که کدام نوکلئیدها بیشترین پایداری را دارند. قاعده 1: هر قدر انرژی اتصال به ازای هر نوکلئون بیشتر باشد، هسته پایدارتر است. انرژی اتصال، انرژی لازم برای جدا کردن هسته به پروتون ها و نوترون های مجزا است. هسته اتم اکسیزن (16 = A ، 8 = Z) هشت پروتون، هشت الکترون و هشت نوترون دارد. این اتم را می توانیم به عنوان هشت اتم هیدروژن (پروتیوم) در نظر بگیریم که هر اتم شامل یک پروتون، یک الکترون و هشت نوترون است. جرم هر اتم پروتیوم 1.0078252 u است. جرم هر نوترون 1.0086654 u است. بنابر این جرم کل یک اتم اکسیژن باید، 16.1319232 u باشد. اما جرم واقعی این ایزوتوپ اکسیژن 15.9949150 u است. تفاوت بین جرم حساب شده و جرم واقعی را نقص جرم می نامند. در مورد اتم اکسیژن نقص جرم .1370082 u است. این جرم به هنگام تشکیل هسته اکسیژن به انرژی تبدیل و آزاد می شود. بنابر این برای جدا کردن نوکلئون ها از یک دیگر نیز همین مقدار انرژی باید به هسته باز گردانده شود. اگر کل انرژی اتصال را در اتم اکسیژن به تعداد کل نوکلئون ها تقسیم کنیم، انرزی اتصال به ازای هر نوکلئون به دست می آید. هر قدر انرژی اتصال به ازای هر نوکلئون بزرگ تر باشد، پایداری هسته بیشتر است. انرژی از دو نوع واکنش با مشارکت هسته آزاد می شود. وقتی یک هسته بزرگ شکافته شده و دو هسته متوسط تشکیل می شود. همچنین وقتی دو هسته کوچک به یک دیگر بپیوندند و یک هسته متوسط تشکیل شود. در هر دو مورد انرژی اتصال به ازای هر نوکلئون در هسته های با اندازه متوسط، بزرگ تر از انرژی های اتصال در هسته های اولیه است. قاعده 2: هسته هایی با عددهای اتمی کوچک و نسبت نوترون به پروتون 1 : 1 بسیار پایدارند. در مورد عددهای اتمی کوچک، این نسبت یک بوده یا خیلی به یک نزدیک است. (اتم اکسیژن با 8 پروتون و 8 نوترون یا اتم پتاسیم با 19 پروتون و 20 نوترون) اما به تدریج با افزایش عدد اتمی، نسبت نوترون به پروتون به طور ثابت افزوده می شود. قاعده 3: پایدارترین هسته ها تمایل دارند تعداد پروتون ها و نوترون های آنها زوج باشد. از بین هسته های شناخته شده پایدار، 57.8 درصد تعداد پروتون و تعداد نوترون زوج دارند. 19.8 درصد از هسته های پایدار، تعداد نوترون زوج و پروتون فرد دارند و 20.9 درصد هسته های پایدار تعداد پروتون زوج و نوترون فرد دارند. فقط 1.5 درصد از هسته های پایدار، تعداد نوترون و پروتون هایشان فرد است. برای تشریح پایداری از روی مقادیر نوترون و پروتون زوج، یک فرض اساسی برای مدل ساختار هسته این است که پروتون ها و نوترون ها در سطوح انرژی نوکلئون قرار دارند، و پایداری بیشتر در نتیجه جفت شدن اسپین های نوکلئون های مشابه است. ( شبیه سطوح انرژی الکترونی و پایداری حاصل از جفت شدن اسپین الکترون ها) منبع: شیمی عمومی با نگرش کاربردی نوشته اسمیت، اسموت، پرایس ترجمه دکتر علی سیدی، مرتضی خلخالی. جلد سوم اصول شیمی عمومی نوشته مارتین سیلبربرگ ترجمه دکتر مجید میرمحمد صادقی، دکتر غلامعباس پارسافر، دکتر محمدرضا سعیدی. جلد دوم |
موضوعات مرتبط: شيمي ، ،
برچسبها:
لگاریتم ها دارای قوانینی هستند که در این بخش به چند قانون آن اشاره می کنیم.
قانون اول: حاصل جمع لگاریتم a در مبنای c با لگاریتم b در مبنای c برابر است با لگاریتم aضربدر b در مبنای c که به صورت زیر نمایش داده می شود.
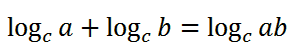
مثال:
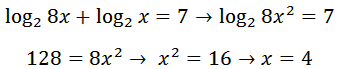
قانون دوم: حاصل تفریق لگاریتم a در مبنای c از لگاریتم b در مبنای c برابر است با لگاریتم a تقسیم بر b در مبنای c که به صورت زیر نمایش داده می شود.
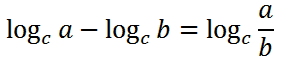
مثال:
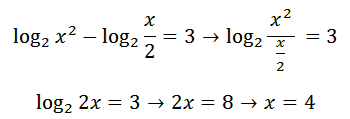
قانون سوم: حاصل لگاریتم a به توان m در مبنای b به توان n برابر m تقسیم n ضربدر لگاریتم a در مبنای b که به صورت زیر نمایش داده می شود.
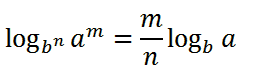
مثال:
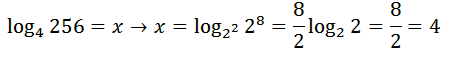
موضوعات مرتبط: رياضي ، ،
برچسبها:




 آمار
وب سایت:
آمار
وب سایت: